Исследование фармакокинетики и биоэквивалентности воспроизведенного и оригинального препарата дабигатрана этексилата при однократном приеме у здоровых добровольцев
https://doi.org/10.15829/1560-4071-2024-6028
EDN: EWLHKQ
Аннотация
Цель. Изучить сравнительную фармакокинетику и подтверждение биоэквивалентности воспроизведенного (T) и оригинального (R) препаратов дабигатрана этексилата у здоровых добровольцев после однократного приема внутрь натощак.
Материал и методы. Для подтверждения биоэквивалентности было проведено открытое рандомизированное репликативное перекрестное четырехэтапное исследование сравнительной фармакокинетики и биоэквивалентности препаратов T и R при однократном приеме в дозе 150 мг дабигатрана этексилата внутрь натощак у взрослых здоровых добровольцев мужского и женского пола. В исследовании приняли участие 68 субъектов. В ходе исследования у добровольцев отбирались образцы плазмы крови, в которых определялась концентрация общего и свободного дабигатрана. На основании полученных данных был проведен фармакокинетический и статистический анализ и рассчитаны 90% доверительные интервалы (ДИ) для отношения средних значений основных фармакокинетических параметров Сmax, Tmax, AUC0-t, AUC0-∞, AUCt-∞, T1/2, AUCt-∞/AUC0-∞ по общему и свободному дабигатрану.
Результаты. Установленные 90% ДИ для отношения значений AUC0-t, AUC0-∞ и Сmax по общему дабигатрану составили — 82,56-96,36% (отношение средних 89,19%), 82,39-95,90% (отношение средних 88,89%) и 85,98-99,17% (отношение средних 92,34%), соответственно. Установленные 90% ДИ для отношения значений AUC0-t, AUC0-∞ и Сmax по свободному дабигатрану составили — 83,37-98,29% (отношение средних 90,53%), 82,98-97,33% (отношение средних 89,87%) и 85,04-99,28% (отношение средних 91,88%), соответственно. Для оцениваемых фармакокинетических параметров дабигатрана этексилата 90% ДИ находились в пределах 80-125% для AUC0-t, AUC0-∞ и Cmax. Проведён дополнительный анализ безопасности. Препараты T и R хорошо переносились добровольцами. Отсутствовали достоверные различия жизненно важных показателей, параметров инструментальных и лабораторных исследований на протяжении всего исследования, а также статистически значимые различия между препаратами по всем изучаемым параметрам нежелательных явлений.
Заключение. По результатам данного исследования можно заключить, что T и R препараты дабигатрана этексилата являются биоэквивалентными. Кроме того, полученные данные указывают на то, что препараты обладают сходными профилями безопасности.
Для цитирования:
Василюк В.Б., Фарапонова М.В., Верведа А.Б., Сыраева Г.И., Вихарев Ю.Б., Попов А.В., Коваленко А.Л. Исследование фармакокинетики и биоэквивалентности воспроизведенного и оригинального препарата дабигатрана этексилата при однократном приеме у здоровых добровольцев. Российский кардиологический журнал. 2024;29(8):6028. https://doi.org/10.15829/1560-4071-2024-6028. EDN: EWLHKQ
For citation:
Vasilyuk V.B., Faraponova M.V., Verveda A.B., Syraeva G.I., Vikharev Yu.B., Popov A.V., Kovalenko A.L. Pharmacokinetics and bioequivalence of the generic and original dabigatran etexilate after a single dose in healthy volunteers. Russian Journal of Cardiology. 2024;29(8):6028. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6028. EDN: EWLHKQ
Лекарственный препарат с международным непатентованным наименованием дабигатрана этексилат (ДЭ) представляет собой пролекарственную форму дабигатрана для орального применения и является прямым обратимым ингибитором тромбина [1][2]. В настоящее время препарат применяется для лечения и профилактики тромбозов глубоких вен, тромбоэмболии легочной артерии, а также в ортопедии [1]. Инсульт является одной из самых частых причин инвалидизации и смерти (11,6%) в мире. В общей популяции чаще встречается ишемический инсульт (ИИ) (~62% от всех типов инсульта). Основной причиной кардиоэмболического ИИ является фибрилляция предсердий, которая обнаруживается у 25-35% пациентов с ИИ [3]. Венозная тромбоэмболия, определяемая как тромбоз глубоких вен и тромбоэмболия легочной артерии, является третьим по распространенности сердечно-сосудистым заболеванием после инфаркта миокарда и инсульта. В Соединенных Штатах ежегодно госпитализируется ~4 млн хирургических пациентов и 8 млн терапевтических пациентов с умеренным или высоким риском венозной тромбоэмболии [4]. После первичного эндопротезирования бессимптомные тромбозы глубоких вен встречаются в 12,6-31,1% случаев. Развитие клинически значимых тромбозов происходит в 0,75-2,10%, тромбоэмболии легочной артерии в 0,41-1,93% случаев [5]. На данный момент для профилактики и лечения ИИ при фибрилляции предсердий и возможных тромбоэмболических осложнений одобрены прямые антикоагулянты, к числу которых относится ДЭ [5][6]. ДЭ включен в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2020г (Приложение № 1 к распоряжению Правительства Российской Федерации от 12 октября 2019г № 2406-р). В России на данный момент зарегистрировано 10 препаратов ДЭ, среди которых как лекарственные средства производства зарубежных компаний (Sandoz, Boehringer Ingelheim), так и отечественного производства. Высокая частотность проведения антикоагулянтной терапии при широком спектре заболеваний, а также хорошая переносимость, простота применения, эффективный антикоагулянтный эффект, предсказуемая фармакокинетика и отсутствие необходимости в рутинном контроле свертывания крови на фоне приема ДЭ [1] делает целесообразной разработку более доступных для населения форм препаратов на его основе. В данной статье представлены результаты исследования биоэквивалентности препарата с торговым наименованием Дабигатрана этексилат (капсулы, производитель Компания ООО "НТФФ "ПОЛИСАН" (Россия)) в сравнении с препаратом под ТН Прадакса®.
Целью настоящего исследования являлось изучение сравнительной фармакокинетики и подтверждение биоэквивалентности T и R препаратов ДЭ у здоровых добровольцев после однократного приема внутрь натощак.
Материал и методы
Этические принципы. Данное исследование было проведено после получения разрешения на проведение клинического исследования Министерства здравоохранения РФ (РКИ № 414 от 07.08.2023г), а также одобрения Совета по этике при нём и локального этического комитета исследовательского центра, в полном соответствии с требованиями надлежащей клинической практики Международного совета по гармонизации, правилами надлежащей клинической практики Евразийского экономического союза, этическими принципами, изложенными в Хельсинкской декларации Всемирной Медицинской Ассоциации. Все добровольцы подписали форму информированного согласия до начала процедур исследования. Протокол клинического исследования DBG-BE-2023, версия 1.1 от 11.08.2023 был одобрен Советом по этике при Министерстве здравоохранения Российской Федерации, выписка № 338 от 11.07.2023.
Дизайн исследования. Дизайн исследования был разработан с учетом как российских рекомендаций по проведению исследований биоэквивалентности 1, так и международных руководств 2. Данное исследование биоэквивалентности являлось открытым, сравнительным, рандомизированным, одноцентровым, репликативным, перекрестным клиническим исследованием с четырьмя периодами по оценке биоэквивалентности препаратов Дабигатрана этексилат, капсулы, 150 мг (ООО "НТФФ "ПОЛИСАН", Россия) (T) и Прадакса®, капсулы, 150 мг (Берингер Ингельхайм Интернешнл ГмбХ, Германия) (R) при однократном приеме внутрь натощак у взрослых здоровых добровольцев мужского и женского пола.
Клинический этап исследования биоэквивалентности был проведен на базе центра ООО "НИЦ Эко-безопасность" в период с 18 августа по 11 октября 2023г. Всего было скринировано 70 человек, из которых 68 здоровых добровольцев мужского и женского пола в возрасте от 19 до 45 лет (включительно) были отобраны в соответствии с критериями включения (по 34 в каждой группе). Все субъекты завершили участие в исследовании согласно протоколу, за исключением трёх добровольцев, которые досрочно завершили участие в исследовании по причине "Отзыв добровольцем информированного согласия" во время первого этапа.
Средний возраст включенных в исследование добровольцев составил 30,7 лет, средний рост — 173,7 см, средняя масса тела — 70,3 кг, средний индекс массы тела — 23,2 кг/м2. По исходным демографическим и антропометрическим характеристикам добровольцев статистически значимых различий между группами обнаружено не было.
Все добровольцы были разделены на 2 группы: группа 1 (Г1) и группа 2 (Г2). Добровольцы, включенные в Г1, в первом и третьем периодах исследования получали по одной капсуле (150 мг ДЭ) Т, а представители Г2 — по одной капсуле (150 мг ДЭ) R. Во втором и четвёртом периодах, соответственно, наоборот: TRTR или RTRT (рис. 1).

Рис. 1. Схема дизайна исследования.
Сокращения: R — референтный препарат, T — воспроизведённый препарат.
На каждом из этапов добровольцы были госпитализированы вечером накануне дня приема препарата (как минимум за 12 ч) двумя когортами в одном клиническом центре и находились там до получения образца крови во временной точке 24 ч (24:00) после приема T/R, образец крови, предусмотренный во временной точке 48 ч (48:00) после приема T/R, был забран в амбулаторном режиме. Все процедуры были стандартизированы, их выполнение контролировалось сотрудниками исследовательского центра. Получение препарата и манипуляции с кровью проводились в одинаковых условиях. Все добровольцы из обеих групп получали одинаковую пищу в каждом из периодов госпитализации, соблюдался единый интервал времени между периодами.
Отбор проб и пробоподготовка. Временные точки отбора биообразцов для оценки концентрации дабигатрана в плазме крови были выбраны таким образом, чтобы получить наиболее полные данные для каждого фрагмента фармакокинетической кривой. С этой целью был предусмотрен частый отбор образцов вблизи Tmax, а также не менее 3-4 точек в течение терминальной фазы. Всего у каждого добровольца в течение этапа было забрано 19 образцов крови: до начала приема тестового/референтного препарата (00:00), через 20 мин (00:20), 40 мин (00:40), 1 ч (01:00), 1 ч 20 мин (01:20), 1 ч 40 мин (01:40), 2 ч (02:00), 2 ч 20 мин (02:20), 2 ч 40 мин (02:40), 3 ч (03:00), 3 ч 30 мин (03:30), 4 ч (04:00), 5 ч (05:00), 6 ч (06:00), 8 ч (08:00), 10 ч (10:00), 14 ч (14:00), 24 ч (24:00), 48 ч (48:00) после приема препаратов.
Образцы крови отбирались с помощью кубитального гепаринизированного катетера, установленного в вену за 60-30 мин до приёма тестового/референтного препарата и удаленного после забора образца крови во временной точке 12 ч после приема препаратов. Далее отбор образцов крови осуществлялся посредством венепункции (с использованием вакуумных пробирок с цитратом натрия в качестве антикоагулянта). В каждую вакуумную пробирку отбиралось до 6 мл крови, пробирки осторожно перемешивали путем переворачивания 8-10 раз, не более чем через 30 мин центрифугировались при 1500 оборотах/мин с холодовым режимом +4±2 С в течение 10 мин для отделения плазмы. Каждый образец плазмы разделялся на две аликвоты путем переноса в пластиковые криопробирки и замораживался при температуре не выше -25 C.
Анализ концентрации действующих веществ в образцах. Исследование биоэквивалентности было проведено путем определения концентраций свободного и общего дабигатрана в плазме крови добровольцев с использованием валидированной методики высокоэффективной жидкостной хроматографии с тандемной масс-спектрометрией согласно требованиям для биоаналитических методов 3. В качестве внутреннего стандарта использовали дабигатран-d3. Анализ полученных образцов проводили на высокоэффективном жидкостном хроматографе Agilent 1260 Infinity II с масс-спектрометрической электроспрей-ионизацией и квадрупольным масс-анализатором Agilent G6470B.
Нижний предел количественного определения свободного и общего дабигатрана в плазме крови составил 0,50 нг/мл (диапазон определяемых концентраций 0,50-400 нг/мл).
Статистический анализ. Статистический анализ параметров фармакокинетики проводили с помощью компьютерных программ Statistica 10.0, R 4.3.2 (Package "bear" 2.9.1 и "replicateBE" 1.1.3) и Microsoft Office Excel 2013. Пакет "bear" полностью валидирован относительно современного коммерческого программного обеспечения — WinNonlin. Математико-статистический анализ параметров безопасности осуществляли с использованием пакетов Microsoft Excel 2013 с надстройками AtteStat, XLStat и Statistica 10.0.
На основании полученных значений концентраций свободного и общего дабигатрана в плазме крови добровольцев в предусмотренные временные интервалы были определены и/или вычислены следующие фармакокинетические показатели: Сmax — максимальная концентрация лекарственного вещества в крови добровольцев; Tmax — время достижения Сmax; AUC0-t — суммарная площадь под кривой концентрации препарата от момента его попадания в организм до t-часа; AUC0-∞ — площадь под кривой "концентрация-время" в интервале времени от 0 до бесконечности; AUCt-∞ — остаточная (экстраполируемая) площадь под кривой; T1/2 — период полувыведения; AUC0-t/AUC0-∞ — отношение площади под кривой "концентрация-время" за время наблюдения к расчетной площади под кривой "концентрация-время" от нуля до бесконечности; f' — относительная биодоступность (AUC0-t(T)/AUC0-t(R)); f'' — относительная скорость абсорбции (Cmax(T)/Cmax(R)). В тексте, согласно протоколу исследования, нормально распределенные данные представлены в виде GM±SD, ассиметрично распределенные — Me (Min; Max). Сравнительный анализ фармакокинетических параметров проводили с помощью непараметрического U-теста Манна-Уитни (Mann-Whitney test) или критерия Стьюдента для независимых выборок (t-test for independent samples) при нормальном распределении (нетрансформированные данные, двусторонний тест).
Оценка биоэквивалентности препаратов производилась путем сравнения границ доверительных интервалов (ДИ) для отношения геометрических средних или медиан показателей AUC0-∞, AUC0-t и Cmax после приема исследуемого и референтного препаратов с установленными границами эквивалентности, равными 80,00-125,00% согласно пункту 81 раздела "Анализируемые параметры и допустимые пределы" 4. AUC0-∞ использовался в качестве дополнительного параметра в связи с тем, что значение AUC0-t превышало 80% значения AUC0-∞. Для установления биоэквивалентности использовался дисперсионный анализ (ANOVA) логарифмически преобразованных показателей дабигатрана, необходимых для оценки биоэквивалентности (AUC0-∞, AUC0-t и Cmax).
Исследование проведено при финансовой поддержке фармацевтической компании ООО "НТФФ "ПОЛИСАН" (Россия).
Результаты и обсуждение
Безопасность
На протяжении всего исследования как препарат T, так и R хорошо переносились добровольцами. Жизненно важные показатели (систолическое артериальное давление, диастолическое артериальное давление, частота сердечных сокращений, частота дыхательных движений, температура тела), параметры инструментальных (электрокардиограмма) и лабораторных исследований на протяжении всего исследования не выходили за пределы референтных интервалов. В ходе проведения исследования было зарегистрировано 32 нежелательных явления (НЯ). Все зарегистрированные НЯ по степени тяжести были легкими. Из них связь с препаратом была вероятной в 15 случаях (46,9%), возможной в 2 случаях (6,3%) и сомнительной в 15 случаях (46,9%) (табл. 1). Наиболее частыми НЯ были головная боль и анемия. Другими НЯ были желудочно-кишечные нарушения (тошнота, боль в животе и флатуленция), сонливость, головокружение, тромбоцитопения, удлинение активированного частичного тромбопластинового времени, повышение артериального давления, снижение аппетита и кровоточивость десен. Данные НЯ перечислены в брошюре исследователя. Во всех 32 случаях каких-либо действий не требовалось.
Фармакокинетические параметры и оценка биоэквивалентности
Фармакокинетические параметры ДЭ в плазме крови добровольцев. Основой для оценки биоэквивалентности являлись концентрации общего и свободного дабигатрана в плазме крови добровольцев. По результатам анализа концентрации общего и свободного дабигатрана в плазме крови добровольцев были рассчитаны значения основных параметров фармакокинетики тестового и референтного препаратов. Обобщённые фармакокинетические параметры общего дабигатрана представлены в таблице 2. Сравнительный анализ фармакокинетических параметров препаратов T и R по общему дабигатрану показал, что р-значения для большинства изучаемых показателей были больше 0,05, что свидетельствовало об отсутствии статистически значимых различий между ними. Статистически значимые различия средних установлены только для показателя T1/2 (р=0,033), которые не относятся к числу основных фармакокинетических параметров.
Обобщённые фармакокинетические параметры свободного дабигатрана у добровольцев после введения препаратов представлены в таблице 3. Сравнительный анализ фармакокинетических параметров препаратов T и R по свободному дабигатрану показал, что р-значения для большинства изучаемых показателей были больше 0,05, что свидетельствовало об отсутствии статистически значимых различий между ними. Статистически значимые различия установлены только для медианных значений показателей T1/2 (р=0,001) и AUCt-∞ (р=0,013), которые не относятся к числу основных фармакокинетических параметров.
Усредненные значения изменения концентрации общего дабигатрана во времени (точках забора препарата) в линейных и полулогарифмических шкалах, соответственно, после однократного приема изучаемых препаратов представлены на рисунках 2 и 3. Как видно из представленных в графическом виде данных, фармакокинетические профили сравниваемых препаратов существенно не отличались, как в линейных координатах, так и для логарифмически преобразованных значений концентрации. Следует отметить более низкий уровень профиля для препарата Т в большинстве анализируемых точек.
Усредненные значения изменения концентрации свободного дабигатрана во времени в линейных и полулогарифмических шкалах, соответственно, после однократного приема изучаемых препаратов представлены на рисунках 4 и 5. Как видно из представленных в графическом виде данных, фармакокинетические профили сравниваемых препаратов существенно не отличались, как в линейных координатах, так и для логарифмически преобразованных значений концентрации. Необходимо отметить, что, как и для общего дабигатрана, наблюдали более низкий уровень профиля для препарата Т в большинстве анализируемых точек.
Оценка биоэквивалентности. Биоэквивалентность тестового и референтного препаратов оценивали на основании фармакокинетических данных общего и свободного дабигатрана с использованием ANOVA. Препараты считались биоэквивалентными, если границы оцененного ДИ для AUC0-t, AUC0-∞ и Cmax находились в пределах 80,00-125,00%. Рассчитанные значения 90% ДИ для отношения средних геометрических значений фармакокинетических параметров AUC0-t, AUC0-∞ и Cmax и коэффициенты внутрииндивидуальной вариации (CVintra) для Т и R по общему и свободному дабигатрану приведены в таблицах 4 и 5.
Полученные ДИ ФКП общего и свободного дабигатрана для AUC0-t, AUC0-∞ и Сmax лежат в пределах, установленных руководящими документами, что говорит о том, что исследуемые препараты биоэквивалентны.
Таблица 1
Сравнительные характеристики общего количества НЯ для препаратов Т и R
Период исследования | Препарат R | Препарат T | ||
Количество НЯ | Количество добровольцев | Количество НЯ | Количество добровольцев | |
1 период | 1 | 1 | 5 | 2 |
2 период | 3 | 3 | 2 | 2 |
3 период | 7 | 5 | 3 | 3 |
4 период | 3 | 3 | 8 | 6 |
Всего | 14 | 12 | 18 | 13 |
Сокращение: НЯ — нежелательное явление.
Таблица 2
Значения фармакокинетических параметров общего дабигатрана после приема препаратов T и R
Фармакокинетические показатели | Препарат T (N=65) | Препарат R (N=65) | р |
Cmax, нг/мл | 120,68±66,63 | 130,50±69,38 | 0,2362 |
Тmax, ч | 2,17 (1,00; 5,00) | 2,33 (1,33; 5,00) | 0,7361 |
AUC0-t, нг∙ч/мл | 960,16 (186,78; 2618,79) | 1029,25 (197,26; 3070,51) | 0,0991 |
Т1/2, ч | 9,62±2,28 | 10,19±2,82 | 0,0332* |
AUC0-∞, нг∙ч/мл | 983,49 (206,96; 2686,77) | 1059,64 (220,68; 3244,42) | 0,0831 |
AUCt-∞, нг∙ч/мл | 0,028 (0,003; 0,164) | 0,034 (0,001; 0,192) | 0,1511 |
AUCt-∞/AUC0-∞, % | 97,2 (83,6; 99,7) | 96,6 (80,8; 99,9) | — |
Примечание: 1 — р-значение при сравнении групп Т и R в Mann-Whitney test; 2 — р-значение при сравнении групп Т и R в t-test for independent samples; * — различия, оцененные с использование Mann-Whitney test, статистически значимы (p≤0,05); нормально распределенные данные представлены в виде GM±SD, ассиметрично распределенные — Me (Min; Max).
Сокращения: AUC0-t — суммарная площадь под кривой концентрации препарата от момента его попадания в организм до t-часа, AUC0-∞ — площадь под кривой "концентрация-время" в интервале времени от 0 до бесконечности, AUCt-∞ — остаточная (экстраполируемая) площадь под кривой, Сmax — максимальная концентрация лекарственного вещества в крови добровольцев, R — референтный препарат, T — воспроизведённый препарат, Tmax — время достижения Сmax, T1/2 — период полувыведения.
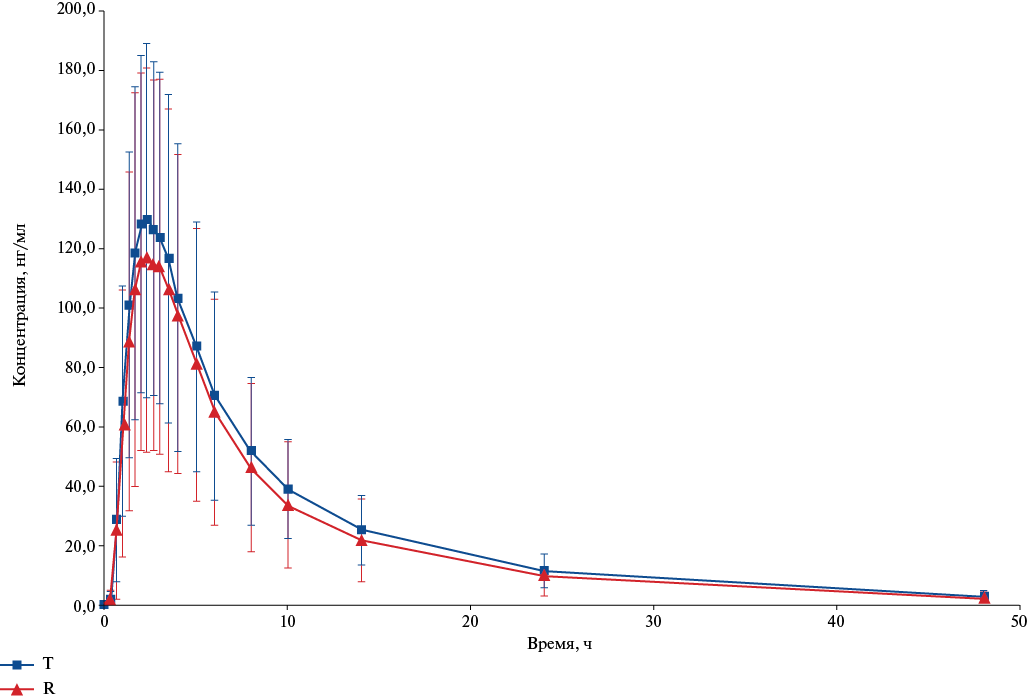
Рис. 2. График усредненных (M±SD) фармакокинетических профилей (в линейных координатах) общего дабигатрана в плазме крови добровольцев после приема препаратов Т и R.
Сокращения: R — референтный препарат, T — воспроизведённый препарат.
Таблица 3
Значения фармакокинетических параметров свободного дабигатрана после приема препаратов T и R
Фармакокинетические показатели | Препарат T (N=65) | Препарат R (N=65) | р |
Cmax, нг/мл | 108,25±57,21 | 117,70±64,48 | 0,1412 |
Тmax, ч | 2,00 (1,33; 4,00) | 2,00 (0,67; 5,00) | 0,8361 |
AUC0-t, нг∙ч/мл | 886,63±486,59 | 979,67±563,68 | 0,0782 |
Т1/2, ч | 9,03 (4,23; 17,44) | 9,85 (5,53; 22,94) | 0,0011* |
AUC0-∞, нг∙ч/мл | 919,36±497,32 | 1023,26±585,01 | 0,0572 |
AUCt-∞, нг∙ч/мл | 0,026 (0,007; 0,147) | 0,033 (0,004; 0,192) | 0,0131* |
AUCt-∞/AUC0-∞, % | 97,4 (85,3; 99,3) | 96,7 (80,8; 99,6) | — |
Примечание: 1 — р-значение при сравнении групп Т и R в Mann-Whitney test; 2 — р-значение при сравнении групп Т и R в t-test for independent samples; * — различия, оцененные с использование Mann-Whitney test, статистически значимы (p≤0,05); Нормально распределенные данные представлены в виде GM±SD, ассиметрично распределенные — Me (Min; Max).
Сокращения: AUC0-t — суммарная площадь под кривой концентрации препарата от момента его попадания в организм до t-часа, AUC0-∞ — площадь под кривой "концентрация-время" в интервале времени от 0 до бесконечности, AUCt-∞ — остаточная (экстраполируемая) площадь под кривой, Сmax — максимальная концентрация лекарственного вещества в крови добровольцев, R — референтный препарат, T — воспроизведённый препарат, Tmax — время достижения Сmax, T1/2 — период полувыведения.
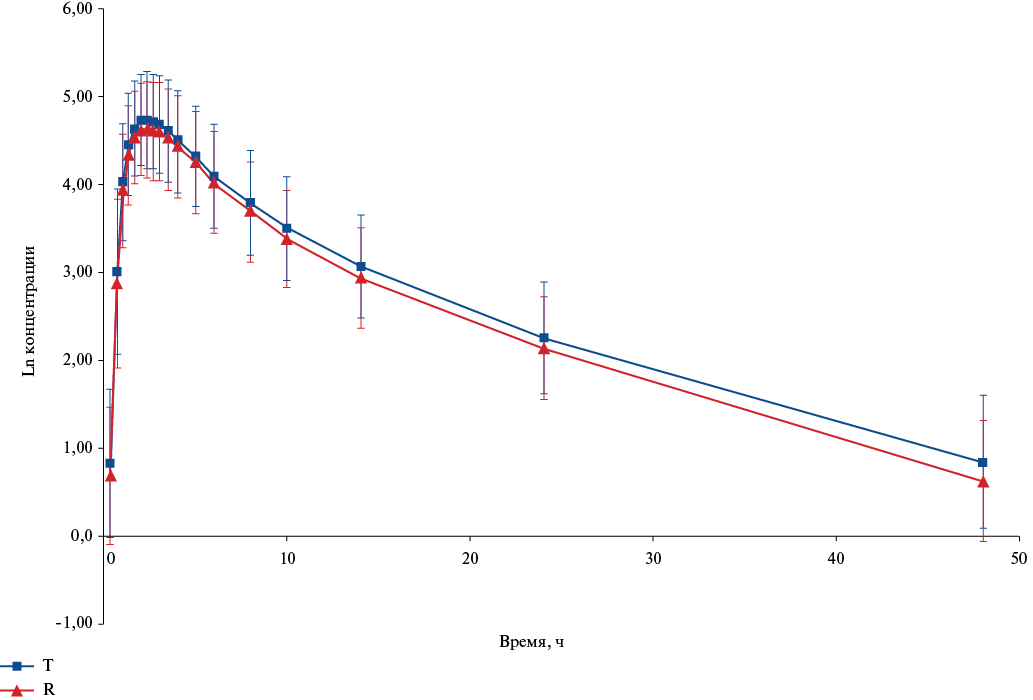
Рис. 3. График усредненных (M±SD) фармакокинетических профилей (в полулогарифмических координатах) общего дабигатрана в плазме крови добровольцев после приема препаратов Т и R.
Сокращения: R — референтный препарат, T — воспроизведённый препарат.
Таблица 4
Статистические критерии, использованные для оценки биоэквивалентности по общему дабигатрану препаратов Т и R и результаты этой оценки (для логарифмически преобразованных значений)
Параметр | GM, значения µT/µR | Коэффициент внутрииндивидуальной вариабельности (CVintraR/CVintraT) | 90% доверительный интервал (min-max) | Критерий биоэквивалентности | |
AUC0-t | 89,19% | 44,23%/45,36% | 82,56-96,36% | 80-125% | выполнен |
AUC0-∞ | 88,89% | 43,05%/44,25% | 82,39-95,90% | 80-125% | выполнен |
Cmax | 92,34% | 40,08%/43,37% | 85,98-99,17% | 80-125% | выполнен |
Сокращения: AUC0-t — суммарная площадь под кривой концентрации препарата от момента его попадания в организм до t-часа, AUC0-∞ — площадь под кривой "концентрация-время" в интервале времени от 0 до бесконечности, Сmax — максимальная концентрация лекарственного вещества в крови добровольцев, CVintraT и CVintraR — коэффициенты внутрииндивидуальной вариации в группах T и R, µT и µR — средние значения фармакокинетических параметров в группах T и R после логарифмического преобразования.
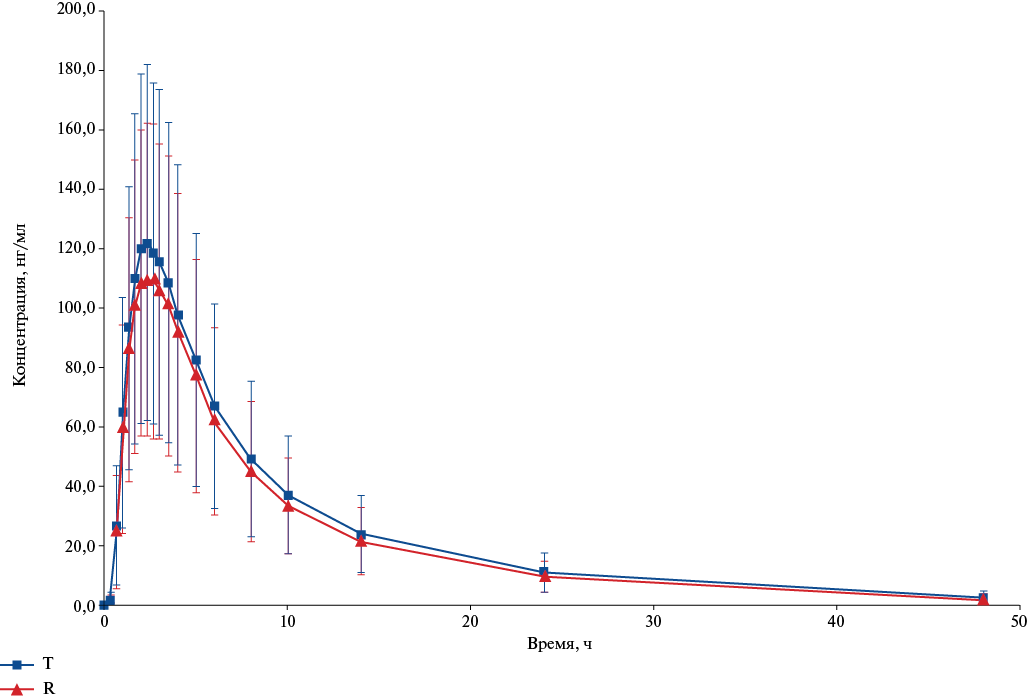
Рис. 4. График усредненных (M±SD) фармакокинетических профилей (в линейных координатах) свободного дабигатрана в плазме крови добровольцев после приема препаратов Т и R.
Сокращения: R — референтный препарат, T — воспроизведённый препарат.
Таблица 5
Статистические критерии, использованные для оценки биоэквивалентности по свободному дабигатрану препаратов Т и R и результаты этой оценки (для логарифмически преобразованных значений)
Параметр | GM, значения µT/µR | Коэффициент внутрииндивидуальной вариабельности (CVintraR/CVintraT) | 90% доверительный интервал (min-max) | Критерий биоэквивалентности | |
AUC0-t | 90,53% | 48,58%/46,57% | 83,37-98,29% | 80-125% | выполнен |
AUC0-∞ | 89,87% | 47,02%/44,76% | 82,98-97,33% | 80-125% | выполнен |
Cmax | 91,88% | 44,50%/45,63% | 85,04-99,28% | 80-125% | выполнен |
Сокращения: AUC0-t — суммарная площадь под кривой концентрации препарата от момента его попадания в организм до t-часа, AUC0-∞ — площадь под кривой "концентрация-время" в интервале времени от 0 до бесконечности, Сmax — максимальная концентрация лекарственного вещества в крови добровольцев, CVintraT и CVintraR — коэффициенты внутрииндивидуальной вариации в группах T и R, µT и µR — средние значения фармакокинетических параметров в группах T и R после логарифмического преобразования.
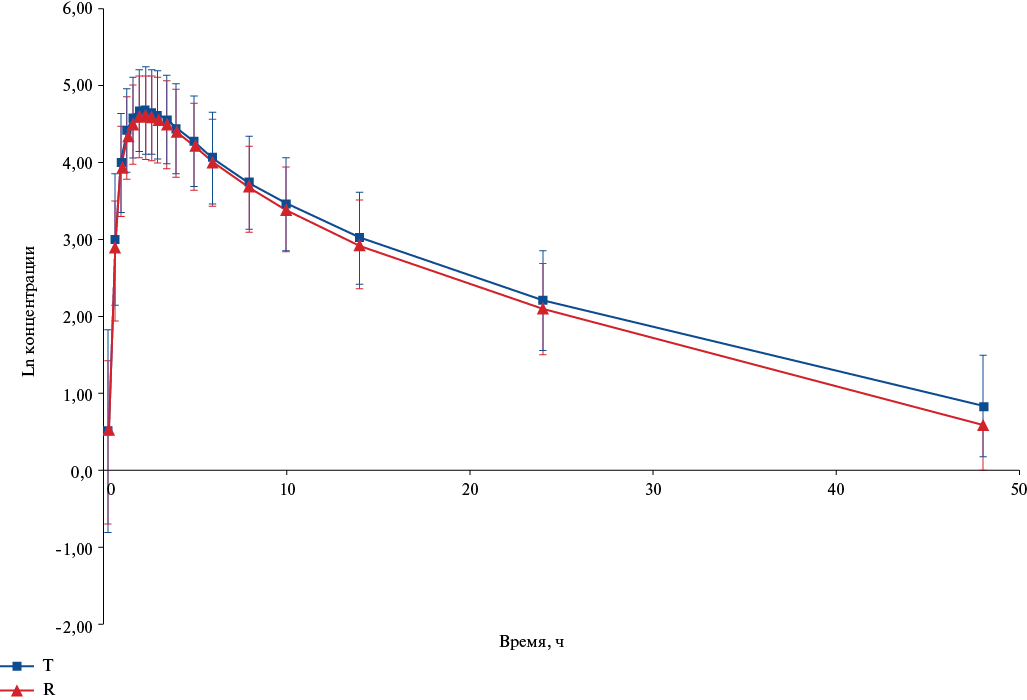
Рис. 5. График усредненных (M±SD) фармакокинетических профилей (в полулогарифмических координатах) свободного дабигатрана в плазме крови добровольцев после приема препаратов Т и R.
Сокращения: R — референтный препарат, T — воспроизведённый препарат.
Заключение
В рамках регистрации воспроизведенного препарата Дабигатрана этексилат было проведено исследование его биоэквивалентности относительно препарата Прадакса® при однократном приеме 150 мг ДЭ здоровыми добровольцами натощак. На основании полученных данных сделано заключение, что исследуемые препараты характеризуются высокой степенью сходства показателей фармакокинетики. Индивидуальные и усредненные профили фармакокинетических кривых воспроизведенного и референтного препаратов ДЭ имеют совпадающие формы. Исследуемые препараты характеризуются близкими значениями показателей относительной биодоступности ДЭ. ДИ для отношений средних геометрических значений оцениваемых показателей тестового и референтного препаратов ДЭ полностью соответствуют установленным пределам.
Также был показан благоприятный профиль безопасности и удовлетворительная переносимость препарата Дабигатрана этексилат, сопоставимые с профилем референтного препарата Прадакса®.
Таким образом, выполненное исследование позволяет констатировать биоэквивалентность воспроизведенного препарата Дабигатрана этексилат, капсулы, 150 мг (ООО "НТФФ "ПОЛИСАН", Россия) относительно референтного препарата Прадакса®, капсулы, 150 мг ("Берингер Ингельхайм Интернешнл ГмбХ", Германия).
Отношения и деятельность. Исследование проведено при финансовой поддержке фармацевтической компании ООО "НТФФ "ПОЛИСАН" (Россия).
↑1 Приказ Министерства здравоохранения РФ от 01.04.2016 № 200н "Об утверждении правил надлежащей клинической практики", Национальный стандарт Российской Федерации ГОСТ Р 52379-2005 "Надлежащая клиническая практика".
↑2 Решение № 85 "Об утверждении правил проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза" от 03.11.2016, CPMP/EWP/QWP/1401/98 Rev.1, 2010.
↑3 Решение № 85 "Об утверждении правил проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза" от 03.11.2016, Приложение № 6 "Требования к валидации биоаналитических методик испытаний и анализу исследуемых биологических образцов", Астана, 2016 (требования БЭ ЕАЭС), Guideline on Bioanalytical Method Validation, European Medicines Agency, Committee for Medicinal Products for Human Use (CHMP), 01 February 2012. (Guide to drug examination, volume 1, p. 201, Grif and K, 2019).
↑4 Решение Евразийской экономической комиссии № 85 "Об утверждении Правил проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза".
Список литературы
↑1. Рубаненко А. О., Рубаненко О. А., Щукин Ю. В. Особенности фармакогенетики дабигатрана: обзор литературы. Вестник аритмологии. 2022;29(1):39-44. https://doi.org/10.35336/VA-2022-1-06.
↑2. Sanford M, Plosker GL. Dabigatran etexilate. Drugs. 2008; 68(12):1699-709. https://doi.org/10.2165/00003495-200868120-00007.
↑3. Остроумова О. Д., Остроумова Т. М. Антикоагулянтная терапия в рамках вторичной профилактики инсульта у пациентов с фибрилляцией предсердий. Неврология, нейропсихиатрия, психосоматика. 2022;14(3):94-100. https://doi.org/10.14412/2074-2711-2022-3-94-100.
↑4. Goldhaber SZ. Venous thromboembolism: Epidemiology and magnitude of the problem. Best Practice & Research Clinical Haematology. 2012;25(3):235-42. https://doi.org/10.1016/j.beha.2012.06.007.
↑5. Божкова С. А., Тихилов Р. М., Андрияшкин В. В. и др. Профилактика, диагностика и лечение тромбоэмболических осложнений в травматологии и ортопедии: методические рекомендации. Травматология и ортопедия России. 2022;28(3):136-66. https://doi.org/10.17816/2311-2905-1993.
↑6. Аракелян М. Г., Бокерия Л. А., Васильева Е. Ю. и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4594. https://doi.org/10.15829/1560-4071-2021-4594.
Для цитирования:
Василюк В.Б., Фарапонова М.В., Верведа А.Б., Сыраева Г.И., Вихарев Ю.Б., Попов А.В., Коваленко А.Л. Исследование фармакокинетики и биоэквивалентности воспроизведенного и оригинального препарата дабигатрана этексилата при однократном приеме у здоровых добровольцев. Российский кардиологический журнал. 2024;29(8):6028. https://doi.org/10.15829/1560-4071-2024-6028. EDN: EWLHKQ
For citation:
Vasilyuk V.B., Faraponova M.V., Verveda A.B., Syraeva G.I., Vikharev Yu.B., Popov A.V., Kovalenko A.L. Pharmacokinetics and bioequivalence of the generic and original dabigatran etexilate after a single dose in healthy volunteers. Russian Journal of Cardiology. 2024;29(8):6028. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6028. EDN: EWLHKQ
















































