Нейротропное действие ботулинического токсина и возможности фармакотерапии ботулизма специфической сывороткой (обзор)
https://doi.org/10.30895/2312-7821-2024-12-3-299-308
Резюме
ВВЕДЕНИЕ. Произошедшая в России в июне 2024 года вспышка пищевого ботулизма в очередной раз продемонстрировала опасность этого довольно редкого, но тяжелого инфекционного заболевания, вызываемого попаданием в организм ботулинического нейротоксина. Единственной этиотропной терапией ботулизма в настоящее время является введение антитоксинов к различным серотипам ботулотоксина. Однако при применении антитоксина не наблюдается быстрый регресс неврологической симптоматики, что может вызвать сомнения в эффективности проводимого лечения. Оценить возможности специфической терапии невозможно без понимания механизмов действия ботулотоксина и антитоксина.
ЦЕЛЬ. Систематизация информации о механизме повреждающего действия ботулинического нейротоксина, этиотропном лечении антитоксином и процессе восстановления пациентов.
ОБСУЖДЕНИЕ. Показано, что механизм повреждающего действия ботулинического нейротоксина заключается в разрушении белков SNARE в пресинаптических окончаниях холинергических нервов, что приводит к нарушению выделения ацетилхолина в синаптическую щель и прекращению передачи возбуждения между нейронами. Отсутствие ацетилхолина в нервно-мышечном синапсе приводит к характерному стойкому вялому мышечному параличу. Специфический механизм действия ботулотоксина определяет тактику лечения, включающую в себя комплекс мероприятий для поддержания жизнеспособности организма и максимально скорое введение противоботулинической сыворотки. Ботулинический антитоксин при применении в течение 48 ч после появления симптомов связывает свободно циркулирующий в крови ботулотоксин, что останавливает прогрессирование паралича и предотвращает развитие дальнейших нарушений у пациентов. Однако антитоксические антитела не могут нейтрализовать действие уже адсорбированного нейротоксина, в связи с чем в течение 12 ч после введения сыворотки клиническая симптоматика может ухудшаться. Восстановление нормальной нейрональной передачи происходит за счет образования новых аксональных окончаний и может занимать длительное время.
ВЫВОДЫ. Введение антитоксина незаменимо в этиотропной терапии ботулизма и является эффективным, однако продолжительность восстановительного периода зависит от скорости процесса реиннервации нервно-мышечной передачи.
Ключевые слова
Для цитирования:
Елисеева Е.М., Мазеркина И.А., Чистохина А.А. Нейротропное действие ботулинического токсина и возможности фармакотерапии ботулизма специфической сывороткой (обзор). Безопасность и риск фармакотерапии. 2024;12(3):299-308. https://doi.org/10.30895/2312-7821-2024-12-3-299-308
For citation:
Eliseeva E.M., Mazerkina I.A., Chistokhina A.A. Neurotropic Effect of Botulinum Toxin and the Potential of Specific Serum Therapy in Botulism (Review). Safety and Risk of Pharmacotherapy. 2024;12(3):299-308. (In Russ.) https://doi.org/10.30895/2312-7821-2024-12-3-299-308
ВВЕДЕНИЕ
Ботулизм относится к острым заболеваниям инфекционно-токсического генеза, обусловленным действием нейротоксина, который вырабатывают вегетативные формы возбудителя Clostridium bоtulinum в анаэробных условиях. Нейротоксин вызывает нарушения нервно-мышечной передачи и, как следствие, парезы и параличи поперечнополосатых и гладких мышц. В случае развития паралича межреберных мышц и диафрагмы возникает острая дыхательная недостаточность, которая в отсутствие доступности реанимационного оборудования может привести к летальному исходу1. Смертность от ботулизма по данным Всемирной организации здравоохранения составляет 5–10%2.
Специфическим лечением при ботулизме является внутривенное введение гетерологичной (лошадиной) противоботулинической сыворотки типов A, B, E3 в максимально короткие сроки после появления симптомов [1]. Антитоксин входит в стандарт лечения при ботулинической инфекции4 и имеет доказанную эффективность. Однако произошедшая в России в июне 2024 г. крупная вспышка ботулизма (более 400 заболевших)5 показала, что не только у пациентов, но даже у медицинских работников ожидания от специфической фармакотерапии противоботулиническим антитоксином завышенные. В реальности восстановление нарушенных в результате отравления нейротоксином функций занимает длительное время, что подтвердилось свидетельствами заболевших6.
Обобщение сведений о механизмах развития повреждающего действия ботулинического токсина и специфического эффекта противоботулинической сыворотки позволит объективно оценить возможности этиотропного лечения ботулизма.
Цель работы — систематизация информации о механизме повреждающего действия ботулинического нейротоксина, этиотропном лечении антитоксином и процессе восстановления пациентов.
Поиск информации проводили в базах данных eLIBRARY.RU, Киберленинка, PubMed по ключевым словам «ботулотоксин», «пищевой ботулизм», «антитоксин противоботулинический». В обзор были включены материалы, опубликованные в период с 2017 по 2024 г. Приоритет отдавали полнотекстовым статьям с подробными описаниями механизмов действия ботулотоксина и антитоксина, а также клинического опыта применения антитоксина при локальных вспышках ботулизма в Российской Федерации, Соединенных Штатах Америки, Испании, Болгарии, Румынии. В обзор были также включены более ранние публикации, посвященные изучению механизмов действия ботулотоксина. Из обзора исключали статьи, описывающие случаи непищевого ботулизма, а также применение ботулотоксина в косметологии.
ОСНОВНАЯ ЧАСТЬ
Этиология
Возбудитель ботулизма C. botulinum — анаэробная грамположительная палочка, широко распространена в природе и образует устойчивые к физическим факторам споры. В благоприятных условиях (питательная среда, ограничение кислорода и др.) споры прорастают и начинают вырабатывать ботулотоксин. Ботулизм человека в большинстве случаев является результатом попадания готового ботулотоксина с пищей7 [1]. Кроме пищевого выделяют несколько других форм ботулизма в зависимости от путей попадания токсина в кровоток: раневой, детского возраста (при заглатывании спор и развитии бактерий в кишечнике у детей в возрасте до 1 года), ингаляционный (при случайных или предумышленных событиях, например биотерроризм, сопровождающихся выделением аэрозоля ботулотоксина)8. Также сообщалось о случаях развития нежелательных явлений, связанных с применением ботокса в косметических или лечебных целях [2]. В настоящее время выделены 7 патогенных типов ботулотоксина, для человека особенно актуальны A, B и E (редко — F) [3]. Большинство клинических случаев ботулизма относятся к пищевому ботулизму9 [4].
Патогенез
Особенности структуры нейротоксина. Ботулинический нейротоксин (botulinum neurotoxin, BoNT) синтезируется в виде комплексов нейротоксина с нековалентно связанными с ним гемагглютининами, обеспечивающими проникновение токсина из кишечника в кровь, и с очень сходным по строению нетоксичным негемагглютининовым белком, выполняющим роль «перчатки», которая защищает нейротоксин (рис. 110) [5]. BoNT — двухцепочечные молекулы, включающие тяжелую и легкую цепи, соединенные дисульфидной связью [6][7]. Тяжелая цепь является вектором и транспортером легкой цепи в нейроны. Легкая цепь BoNT — цинковая металлопротеаза, расщепляющая белки, которые обеспечивают выделение медиатора ацетилхолина в холинергических синапсах соматической и вегетативной нервной системы [8].
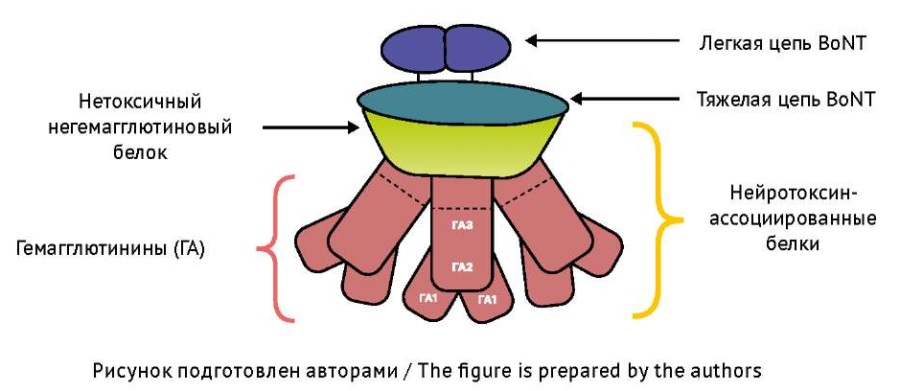
Рис. 1. Структура комплекса предшественника ботулинического нейротоксина (BoNT)
Fig. 1. Botulinum neurotoxin (BoNT) progenitor complex structure
Особенности транспорта. Всасывание веществ из кишечника ограничено их строением, размерами и липофильностью. Особенностью строения кишечного эпителия является наличие плотных контактов между энтероцитами, ограничивающими парацеллюлярный транспорт крупных молекул и гидрофильных веществ из просвета кишечника (рис. 211) [9]. Гемагглютинин, входящий в состав комплекса токсина предшественника BoNT (КТП), способствует проникновению токсина через эпителий кишечника с помощью двух механизмов, обеспечивающих системную высокую токсичность BoNT. Одним из механизмов является связывание ботулинического гемагглютинина с гликопротеином 2 (ГП2) на поверхности М-клеток кишечного эпителия с последующим образованием эндосомы, которая транспортирует комплекс через клетку в кровь [10][11]. Другим путем проникновения КТП является парацеллюлярный транспорт между энтероцитами за счет разрушения барьера, включающего мембранный белок Е-кадгерин. Гемагглютинин при связывании с E-кадгерином разрывает его, тем самым нарушая межклеточный барьер и облегчая парацеллюлярное всасывание BoNТ [12]. После кишечной абсорбции BoNT быстро попадет в кровь [13]. В слабощелочной среде крови белки, сопровождающие BoNT, отсоединяются, и в дальнейшем с мишенями токсина взаимодействуют только две цепи BoNT [10]. Таким образом, кровь является главным депо BoNT, откуда он поступает в клетки нервной системы.
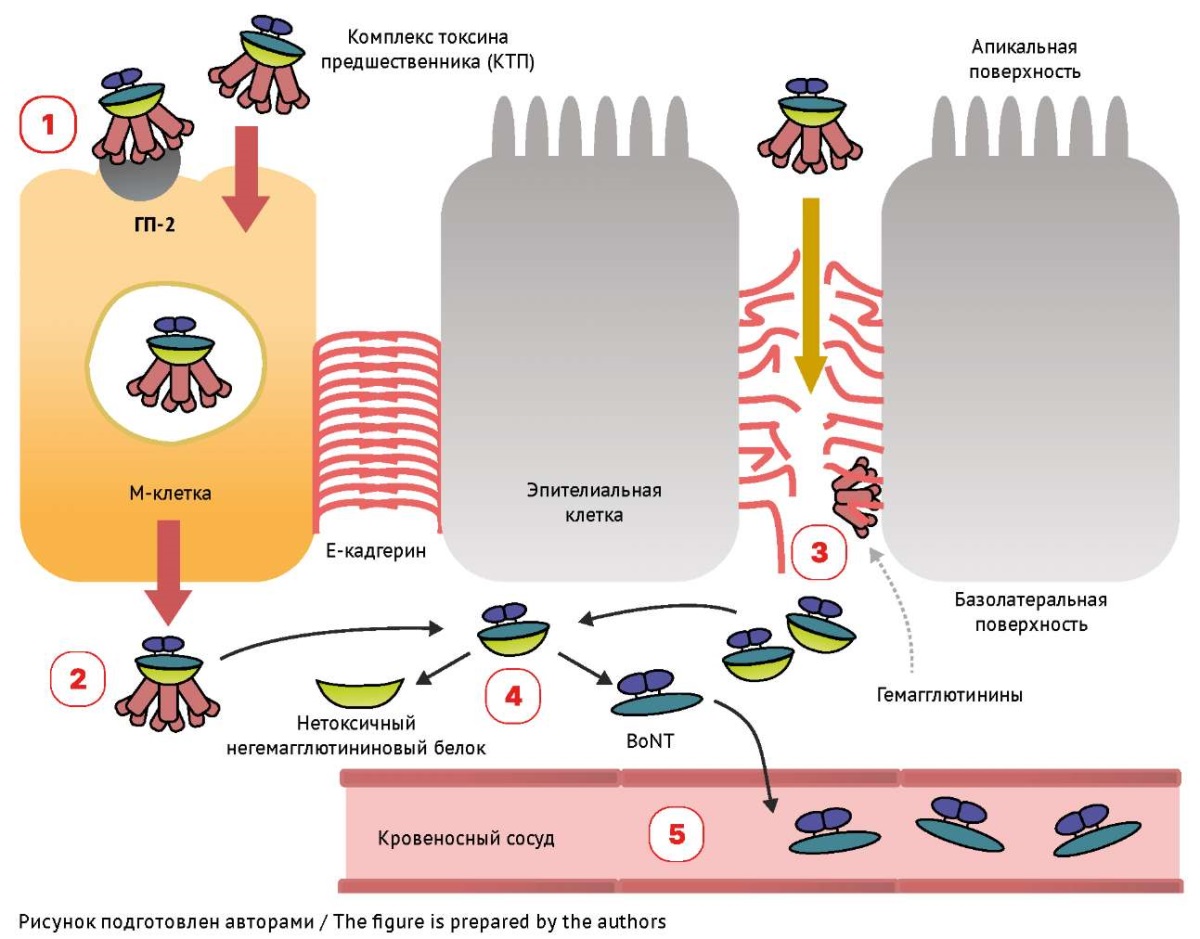
Рис. 2. Механизм кишечной абсорбции комплекса ботулинического нейротоксина (BoNT) типа А: (1) Комплекс токсина предшественника (КТП) связывается с гликопротеином 2 (ГП2) на М-клетках. (2) Путем трансцитоза КТП преодолевает эпителиальные барьеры М-клеток кишечника. (3) Гемагглютинины связываются с Е-кадгерином и разрывают адгезионные соединения между энтероцитами. (4) Диссоциация КТП с высвобождением BoNT во внеклеточной области. (5) Переход BoNT в кровь
Fig. 2. Mechanism of intestinal absorption of botulinum neurotoxin (BoNT) type A complex: (1) A progenitor toxin complex (КТП) binds to glycoprotein 2 (ГП2) expressed on M-cells. (2) The progenitor toxin complex crosses intestinal M-cell epithelial barriers by transcytosis. (3) Haemagglutinins bind to E-cadherin and disrupt adherens junctions between enterocytes. (4) The progenitor toxin complex dissociates to release BoNT in the extracellular region. (5) The released BoNT enters the blood stream
Механизм повреждающего действия. Основными мишенями BoNT являются холинергические пресинаптические окончания, к структурам которых токсин имеет высокое сродство [14]. В норме в пресинаптическом окончании синаптические везикулы, содержащие ацетилхолин, расположены вблизи от клеточной мембраны за счет нескольких белок-белковых взаимодействий (рис. 312) [13]. Наиболее важными из этих структур являются белки SNARE (растворимые рецепторы белка прикрепления, чувствительные к N-этилмалеимиду) и SM (подобные Sec1/Munc18), расположенные как в мембране везикул, так и в пресинаптической мембране. Комплекс SNARE включает синаптобревин, синтаксин и SNAP-25 [15][16]. Расположенные в непосредственной близости от этих комплексов потенциалзависимые Ca²+-каналы открываются в ответ на потенциал действия, позволяя Ca²+ проникать в клетку. Увеличение концентрации внутриклеточного Ca²+ запускает связывание синаптотагмина с комплексом SNARE/SM, который обеспечивает каркас для стягивания двух мембран вместе и обеспечивает слияние мембраны везикулы с пресинаптической мембраной и последующее высвобождение ацетилхолина в синаптическую щель [17][18].

Рис. 3. Механизм поражения пресинаптических нервных окончаний ботулиническим нейротоксином (BoNT): (1) Выделение ацетилхолина (АЦХ) в норме. (2–3) Тяжелая цепь BoNT с высоким сродством связывается с белками пресинаптической мембраны окончаний скелетных и вегетативных холинергических нервов. Высокая избирательность связывания обусловлена способностью BoNT взаимодействовать с двумя структурами пресинаптической мембраны: полисиалоганглиозидом (ПСГ) и гликопротеином синаптических пузырьков 2A (СП2А), представляющим собой трансмембранный белок синаптических пузырьков. (4) Рецептор-опосредованный эндоцитоз комплекса ПСГ–BoNT. (5) Ацидификация среды синаптической эндосомы. (6) Освобождение легкой цепи BoNT от тяжелой цепи. (7) Выход легкой цепи BoNT из соматической эндосомы в цитоплазму. (8) Разрушение белков-мишеней SNAP-25, VAMP (синаптобревин), синтаксин легкой цепью BoNT. (8a) BoNT/B, BoNT/D, BoNT/F, BoNT/G расщепляют VAMP (синаптобревин). (8b) BoNT/A, BoNT/E и BoNT/C расщепляют SNAP-25. (8c) BoNT/C расщепляет синтаксин. (9) Нарушение экзоцитоза ацетилхолина
Fig. 3. Mechanism of damage to presynaptic nerve endings by botulinum neurotoxin (BoNT): (1) Normal acetylcholine (АЦХ) release. (2–3) High-affinity binding of the BoNT heavy chain to proteins of the presynaptic membrane of skeletal and autonomic cholinergic nerve terminals, with high binding selectivity due to the ability of BoNT to interact with two structures of the presynaptic membrane, including polysialoganglioside (ПСГ) and synaptic vesicle glycoprotein 2A (СП2A, a transmembrane protein of synaptic vesicles). (4) Receptor-mediated endocytosis of the polysialoganglioside–BoNT complex. (5) Acidification of the synaptic endosome environment. (6) Release of the BoNT light chain from the heavy chain. (7) Release of the BoNT light chain from the somatic endosome into the cytoplasm. (8) Destruction of target proteins—SNAP-25 (synaptosomal-associated protein), VAMP (vesicle-associated membrane protein; synaptobrevin), and syntaxin—by the light chain of BoNT. (8a) Cleavage of VAMP by BoNT/B, BoNT/D, BoNT/F, and BoNT/G. (8b) Cleavage of SNAP-25 by BoNT/A, BoNT/E, and BoNT/C. (8c) Cleavage of syntaxin by BoNT/C. (9) Disruption of acetylcholine exocytosis
Механизм поражения пресинаптических нервных окончаний ботулотоксином можно разделить на четыре основных этапа [13]:
1) связывание тяжелой цепи BoNT с гликопротеинами на поверхности нервных окончаний;
2) включение BoNT в эндосому;
3) высвобождение легкой цепи токсина через мембрану эндосомы в цитоплазму пресинаптического окончания;
4) расщепление белков VAMP (синаптобревин), SNAP-25, синтаксина, участвующих в экзоцитозе ацетилхолина из везикулы, что вызывает нарушение выделения ацетилхолина в синаптическую щель с последующим развитием вялого паралича.
Нейротоксин с помощью тяжелой цепи фиксируется вначале с полисиалоганглиозидом (ПСГ) на пресинаптической мембране окончаний скелетных и вегетативных холинергических нервов [8][14]. Затем BoNT взаимодействует с белковыми рецепторами пресинаптической мембраны гликопротеиномами синаптических пузырьков 2A (СП2А) [13][19]. Связывание токсина с этими рецепторами стимулирует рецептор-опосредованный эндоцитоз с формированием эндосомы, в которой формируется кислая среда, что приводит к разъединению легкой и тяжелой цепей токсина и последующей транслокации легкой цепи в цитозоль пресинаптического окончания [8]. В цитозоле легкая цепь токсина, обладающая каталитической активностью, активируется и расщепляет свои мишени — белки SNARE. Серотипы нейротоксина имеют различные мишени: BoNT/B и BoNT/F расщепляют VAMP; BoNT/A и BoNT/E расщепляют SNAP-25 [8][20]. Расщепление нейротоксином белков SNARE приводит к нарушению выделения ацетилхолина в синаптическую щель и прекращению передачи возбуждения между нейронами. Отсутствие ацетилхолина в нервно-мышечном синапсе приводит к стойкому вялому мышечному параличу, характерному для ботулизма [13][21]. BoNT/A блокирует высвобождение не только ацетилхолина, но и других нейромедиаторов: адреналина, норадреналина, дофамина, глутамата, глицина, серотонина, вещества Р, однако с меньшей эффективностью [14][22].
Исторически считалось, что BoNT действует исключительно на периферические нервные окончания, так как не проникает через гематоэнцефалический барьер. В настоящее время выделяют по крайней мере три возможных механизма, с помощью которых BoNT может влиять на активность ЦНС [23]:
1) блокада гамма-моторных окончаний, уменьшающая афферентные импульсы нервно-мышечных веретен инъецированной мышцы;
2) пластические изменения после блокады нервно-мышечной передачи;
3) ретроградный транспорт и трансцитоз, то есть высвобождение лиганда в синаптической щели с возможным поглощением нейронами второго порядка.
Подробное рассмотрение механизма повреждающего действия ботулинического токсина указывает, таким образом, на невозможность восстановления утраченных функций поврежденных синапсов. Однако в крови остается не связанный с нервными окончаниями токсин, на который и должна быть направлена терапия для предотвращения дальнейших повреждений.
Специфическое и неспецифическое лечение
Единственный существующий специфический метод лечения ботулизма — введение гетерологичной (лошадиной) противоботулинической сыворотки типов A, B, E13 [24]. В России для лечения заболевания, вызванного неизвестным типом токсина, используют смесь трех моновалентных сывороток типов А, В и Е (международное непатентованное наименование — Антитоксин ботулинический типов А, В и Е). При лабораторно установленном типе токсина используют моновалентную сыворотку соответствующего типа. Вне зависимости от степени выраженности симптомов вводят только одну лечебную дозу препарата однократно14. В США на сегодняшний день применяется семивалентный ботулинический антитоксин15 (heptavalent botulinum antitoxin, HBAT), содержащий в себе фрагменты иммуноглобулина и поликлональных антител Fab и F(ab’)2, которые активны против 7 подтипов ботулотоксина [25].
Антитоксин ботулинический содержит антитела или антигенсвязывающие фрагменты антител, которые связывают нейротоксин [25]. Действие антитоксина заключается в нейтрализации в крови ботулотоксина, который еще не связался с синаптическими рецепторами. В результате образуется комплекс антитоксин–токсин, который выводится из кровотока [26]. При введении на ранних стадиях заболевания (в течение 48 ч после появления симптомов) ботулинический антитоксин останавливает прогрессирование паралича и предотвращает дальнейшие нарушения у пациентов [27]. Однако антитоксические антитела не могут нейтрализовать действие уже адсорбированного на нервных структурах нейротоксина, поэтому в течение 12 ч после введения сыворотки клиническая симптоматика может ухудшаться16.
Помимо этиотропной терапии стандарт лечения ботулизма включает тактику неотложной помощи: прекращение поступления и дальнейшего всасывания токсина в кровь с помощью зондового промывания желудка и высоких очистительных клизм с целью удаления и выведения свободного нейротоксина. При декомпенсированной острой дыхательной недостаточности и нарушении глотания необходимо направление пациента в палату интенсивной терапии и реанимации, где доступны интубация и механическая вентиляция легких17 [28].
Таким образом, главная цель введения антитоксина — связать и вывести находящийся в крови ботулинический токсин для предотвращения развития тяжелых нарушений, в частности, дыхательной недостаточности, основной причины смерти на ранних стадиях ботулизма [29]. Применение ботулинического антитоксина не влияет на скорость восстановления процессов нервно-мышечной передачи, поэтому уже развившиеся неврологические нарушения не могут быть быстро купированы. Остальные меры терапии при ботулизме направлены на поддержание организма до восстановления передачи возбуждения в холинергических нейронах.
Восстановление нервно-мышечной передачи
Поврежденные ботулотоксином синаптические окончания восстановить невозможно. При нарушении функции нерва восстановление утраченных свойств осуществляется за счет сохранившихся нервных волокон, которые начинают интенсивно ветвиться в зоне терминалей. Данный процесс получил название «терминальный (регенераторный) спраутинг» (от англ. to sprout — пускать ростки, ветвиться). За счет спраутинга постепенно происходит полное замещение функций необратимо поврежденных в ходе ботулизма аксонов (рис. 4) [30].
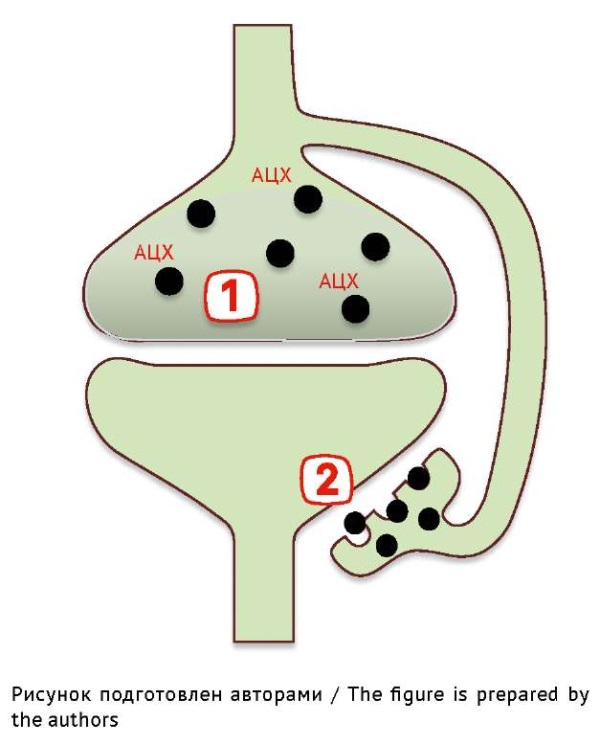
Рис. 4. Спраутинг нервно–мышечного соединения: (1) Необратимо заблокированный нейромышечный синапс. (2) Новый отросток аксона, по которому возобновилась передача ацетилхолина (АЦХ)
Fig. 4. Neuromuscular junction sprouting: (1) Irreversibly blocked neuromuscular synapse. (2) New axonal sprout with resumed acetylcholine (АЦХ) transmission
Регенеративный спраутинг конечного участка аксона осуществляется конусами роста — специализированными структурами, которые представляют собой груше- и булавовидные расширения терминалей нервных волокон (10×5–8 мкм) [27]. Процесс реиннервации происходит в течение 3–4 месяцев. Возобновление передачи нервного импульса осуществляется по мере формирования новых нервно-мышечных контактов (моторных синаптических бляшек) [31].
Время выздоровления зависит от количества заблокированных нейромышечных синапсов и скорости регенерации нервных окончаний и пресинаптических мембран [32]. При легкой форме ботулизма выздоровление происходит практически самостоятельно. При тяжелой форме лечение в отделении реанимации и интенсивной терапии может быть длительным: описан случай пребывания пациента на искусственной вентиляции легких 127 сут [33], в отделении реанимации — до 300 сут [34].
ЗАКЛЮЧЕНИЕ
Ботулотоксин имеет высокое сродство к структурам холинергических пресинаптических окончаний, что делает его недоступным для обезвреживания внутри синапсов. Кровь является главным источником токсина при дальнейшем развитии заболевания, поэтому этиотропная терапия при ботулизме заключается в связывании свободно циркулирующего токсина, который еще не попал в синапс.
Единственным специфическим лечением ботулизма является введение противоботулинической сыворотки. Успешность специфического лечения ботулиническим антитоксином зависит от своевременного его введения, поэтому крайне важна информированность и настороженность медицинских работников в плане клинических проявлений ботулизма. При применении антитоксина следует учитывать возможное ухудшение симптоматики в течение 12 ч после введения сыворотки, обусловленное действием токсина, уже попавшего в нейроны и поэтому недоступного для нейтрализации.
Восстановление нормальной нервно-мышечной передачи происходит за счет образования новых аксональных окончаний и возможно даже при тяжелой форме ботулизма. Восстановление организма может занимать длительное время, поэтому помимо вовремя поставленного диагноза важную роль играет доступность реанимационного ресурса для поддержания жизненных функций организма.
Является ли оправданным предположение о неэффективности применения антитоксина при ботулизме? Систематизация и анализ данных о механизме действия ботулинического токсина и специфическом методе лечения пищевого ботулизма позволяют сделать однозначный вывод: введение антитоксина незаменимо в этиотропной терапии заболевания и является эффективным, что подтверждает многолетний опыт его применения в соответствии со стандартами лечения во многих странах мира.
Дополнительная информация. На сайте журнала «Безопасность и риск фармакотерапии» размещены рисунки 1–3 на английском языке.
https://doi.org/10.30895/2312-7821-2024-12-3-f1
https://doi.org/10.30895/2312-7821-2024-12-3-f2
https://doi.org/10.30895/2312-7821-2024-12-3-f3
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Е.М. Елисеева, А.А. Чистохина — сбор и анализ литературы, написание и редактирование текста рукописи, подготовка графических материалов; И.А. Мазеркина — сбор и анализ литературы, написание текста рукописи, формулировка выводов.
Additional information. Figures 1–3 in English are published on the website of Safety and Risk of Pharmacotherapy.
https://doi.org/10.30895/2312-7821-2024-12-3-f1
https://doi.org/10.30895/2312-7821-2024-12-3-f2
https://doi.org/10.30895/2312-7821-2024-12-3-f3
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Ekaterina M. Eliseeva and Anna A. Chistokhina collected and analysed scientific literature, drafted and edited the manuscript, and prepared the graphical material. Irina A. Mazerkina collected and analysed scientific literature, drafted the manuscript, and formulated the conclusions.
↑1. Ботулизм у детей. Клинические рекомендации. Министерство здравоохранения Российской Федерации; 2021.
↑2. Ботулизм. Всемирная организация здравоохранения. https://www.who.int/ru/news-room/fact-sheets/detail/botulism
↑3. Никифоров ВВ, Чуланов ВП, Кожевникова АВ, Тюрин ИН, Антипят НА, Сохликов АА и др. Методические рекомендации. Краткая версия. Диагностика и лечение ботулизма. 2024.
↑4. Ботулизм у детей. Клинические рекомендации. Министерство здравоохранения Российской Федерации; 2021.
↑5. https://www.rospotrebnadzor.ru/about/info/news/news_details.php?ELEMENT_ID=27998&sphrase_id=5354806
↑6. https://msk1.ru/text/health/2024/06/25/73746452/?ysclid=m0dy9picuw272196771
↑7. Никифоров ВВ. Ботулизм. В кн.: Ющук НД, Венгеров ЮЯ, ред. Инфекционные болезни: национальное руководство. М.: ГЭОТАР-Медиа; 2018. С. 558–68.
↑8. Ботулизм. Всемирная организация здравоохранения. https://www.who.int/news-room/fact-sheets/detail/botulism
↑9. Санин БИ. Ботулизм. В кн.: Лучшев ВИ, Жаров СН, ред. Избранные лекции по инфекционным болезням и эпидемиологии. Учебно-методическое пособие. М.: ГОУ ВПО РГМУ, МИМСР; 2004. С. 219–39.
↑10. Англоязычная версия рисунка 1 размещена на сайте журнала. https://doi.org/10.30895/2312-7821-2024-12-3-f1
↑11. Англоязычная версия рисунка 2 размещена на сайте журнала. https://doi.org/10.30895/2312-7821-2024-12-3-f2
↑12. Англоязычная версия рисунка 3 размещена на сайте журнала. https://doi.org/10.30895/2312-7821-2024-12-3-f3
↑13. Никифоров ВВ, Чуланов ВП, Кожевникова АВ, Тюрин ИН, Антипят НА, Сохликов АА и др. Методические рекомендации. Краткая версия. Диагностика и лечение ботулизма. 2024.
↑14. Ботулизм у детей. Клинические рекомендации. Министерство здравоохранения Российской Федерации; 2021.
↑15. https://www.fda.gov/vaccines-blood-biologics/approved-blood-products/bat-botulism-antitoxin-heptavalent-b-c-d-e-f-g-equine
↑16. ФС.3.3.1.0042.15 Сыворотки противоботулинические типов А, В, Е лошадиные. Государственная фармакопея Российской Федерации. XIV изд. Т. 4. М.; 2018.
↑17. Ботулизм у детей. Клинические рекомендации. Министерство здравоохранения Российской Федерации; 2021.
Список литературы
↑1. Никифоров ВВ. Ботулизм. СПб: Эко-Вектор; 2024. EDN: NDPUMZ
↑2. Eser F, Hasanoğlu İ, Kayaaslan B, Kaya Kalem A, Bilen Ş, Orhan G, Güner R. Iatrogenic botulism cases after gastric and axillary application of botulinum toxin and review of literature. J Infect Dev Ctries. 2024;18(3):480-7. https://doi.org/10.3855/jidc.18868
↑3. Rasetti-Escargueil C, Lemichez E, Popoff MR. Public health risk associated with botulism as foodborne zoonoses. Toxins (Basel). 2019;12(1):17. https://doi.org/10.3390/toxins12010017
↑4. Lonati D, Schicchi A, Crevani M, Buscaglia E, Scaravaggi G, Maida F, et al. Foodborne botulism: clinical diagnosis and medical treatment. Toxins (Basel). 2020;12(8):509. https://doi.org/10.3390/toxins12080509
↑5. Poulain B, Popoff MR. Why are botulinum neurotoxin-producing bacteria so diverse and botulinum neurotoxins so toxic? Toxins (Basel). 2019;11(1):34. https://doi.org/10.3390/toxins11010034
↑6. Eswaramoorthy S, Kumaran D, Keller J, Swaminathan S. Role of metals in the biological activity of Clostridium botulinum neurotoxins. Biochemistry. 2004;43(8):2209-16. https://doi.org/10.1021/bi035844k
↑7. Chen S, Barbieri JT. Association of botulinum neurotoxin serotype. A light chain with plasma membrane-bound SNAP25. J Biol Chem. 2011;286(17):15067-72. https://doi.org/10.1074/jbc.M111.224493
↑8. Rawson AM, Dempster AW, Humphreys CM, Minton NP. Pathogenicity and virulence of Clostridium botulinum. Virulence. 2023;14(1):2205251. https://doi.org/10.1080/21505594.2023.2205251
↑9. Yu Z, Liu D, Wu C, Zhao W. Intestinal absorption of bioactive oligopeptides: paracellular transport and tight junction modulation. Food Funct. 2024;15(12):6274-88. https://doi.org/10.1039/d4fo00529e
↑10. Matsumura T. Mechanism of intestinal absorption of botulinum neurotoxin complex. Jpn J Bacteriol. 2019;74(3):167-75. https://doi.org/10.3412/jsb.74.167
↑11. Amatsu S, Fujinaga Y. Botulinum hemagglutinin: critical protein for adhesion and absorption of neurotoxin complex in host intestine. Methods Mol Biol. 2020;2132:183-90. https://doi.org/10.1007/978-1-0716-0430-4_19
↑12. Lee K, Zhong X, Gu S, Kruel AM, Dorner MB, Perry K, et al. Molecular basis for disruption of E-cadherin adhesion by botulinum neurotoxin A complex. Science. 2014;344(6190):1405-10. https://doi.org/10.1126/science.1253823
↑13. Pirazzini M, Rossetto O, Eleopra R, Montecucco C. Botulinum neurotoxins: biology, pharmacology, and toxicology. Pharmacol Rev. 2017;69(2):200-35. https://doi.org/10.1124/pr.116.012658
↑14. Poulain B, Lemichez E, Popoff MR. Neuronal selectivity of botu linum neurotoxins. Toxicon. 2020;178:20-32. https://doi.org/10.1016/j.toxicon.2020.02.006
↑15. Yamamoto H, Ida T, Tsutsuki H, Mori M, Matsumoto T, Kohda T, et al. Specificity of botulinum protease for human VAMP family proteins. Microbiol Immunol. 2012;56(4):245-53. https://doi.org/10.1111/j.1348-0421.2012.00434.x
↑16. Connan C, Popoff MR. Two-component systems and toxinogenesis regulation in Clostridium botulinum. Res Microbiol. 2015;166(4):332-43. https://doi.org/10.1016/j.resmic.2014.12.012
↑17. Han J, Pluhackova K, Böckmann RA. The multifaceted role of snare proteins in membrane fusion. Front Physiol. 2017;8:5. https://doi.org/10.3389/fphys.2017.00005
↑18. Jahn R, Cafiso DC, Tamm LK. Mechanisms of SNARE proteins in membrane fusion. Nat Rev Mol Cell Biol. 2024;25(2):101-18. https://doi.org/10.1038/s41580-023-00668-x
↑19. Rossi R, Arjmand S, Bærentzen SL, Gjedde A, Landau AM. Synaptic vesicle glycoprotein 2A: features and functions. Front Neurosci. 2022;16:864514. https://doi.org/10.3389/fnins.2022.864514
↑20. Pirazzini M, Azarnia Tehran D, Leka O, Zanetti G, Rossetto O, Montecucco C. On the translocation of botulinum and tetanus neurotoxins across the membrane of acidic intracellular compartments. Bio chim Biophys Acta. 2016;1858(3):467-74. https://doi.org/10.1016/j.bbamem.2015.08.014
↑21. Păuna AM, Crăciun MD, Sîrbu A, Popescu R, Enciu BG, Chivu CD, et al. Botulism cases in romania-an overview of 14-year national surveillance data. Biomedicines. 2024;12(5):1058. https://doi.org/10.3390/biomedicines12051058
↑22. Reznik AV. The pharmacology of botulinum toxin type A. In: Sabuncuoglu S, ed. Botulinum toxin - recent topics and applications. Intech Open; 2022. https://doi.org/10.5772/intechopen.101315
↑23. Marchand-Pauvert V, Aymard C, Giboin LS, Dominici F, Rossi A, Mazzocchio R. Beyond muscular effects: depression of spinal recurrent inhibition after botulinum neurotoxin A. J Physiol. 2013;591(4):1017-29. https://doi.org/10.1113/jphysiol.2012.239178
↑24. Harvey RR, Cooper R, Bennett S, Richardson M, Duke D, Stoughton C, et al. Outbreak of foodborne botulism in an immigrant community: overcoming delayed disease recognition, ambiguous epidemiologic links, and cultural barriers to identify the cause. Clin Infect Dis. 2017;66( suppl_1):82-4. https://doi.org/10.1093/cid/cix817
↑25. Ni SA, Brady MF. Botulism Antitoxin. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2023.
↑26. Yu PA, Lin NH, Mahon BE, Sobel J, Yu Y, Mody RK, et al. Safety and improved clinical outcomes in patients treated with new equine-derived heptavalent botulinum antitoxin. Clin Infect Dis. 2017;66(suppl_1):57-64. https://doi.org/10.1093/cid/cix816
↑27. Chalk CH, Benstead TJ, Pound JD, Keezer MR. Me dical treatment for botulism. Cochrane Database Syst Rev. 2019;4(4):CD008123. https://doi.org/10.1002/14651858.CD008123.pub4
↑28. Chatham-Stephens K, Fleck-Derderian S, Johnson SD, Sobel J, Rao AK, Meaney-Delman D. Clinical features of foodborne and wound botulism: a syste matic review of the literature, 1932-2015. Clin Infect Dis. 2017;66(suppl_1):11-6. https://doi.org/10.1093/cid/cix811
↑29. Rao AK, Sobel J, Chatham-Stephens K, Luquez C. Clinical guidelines for diagnosis and treatment of botulism, 2021. MMWR Recomm Rep. 2021;70(2):1-30. https://doi.org/10.15585/mmwr.rr7002a1
↑30. Benedetto AV. The cosmetic uses of Botulinum toxin type A. Int J Dermatol. 1999;38:641-55. https://doi.org/10.1046/j.1365-4362.1999.00722.x
↑31. Толмачева ВА. Постинсультная спастичность, индивидуализированный подход к лечению. Неврология, нейропсихиатрия, психосоматика. 2016;8(4):71-6. https://doi.org/10.14412/2074-2711-2016-4-71-76
↑32. O’Horo JC, Harper EP, El Rafei A, Ali R, DeSimone DC, Sakusic A, et al. Efficacy of antitoxin therapy in treating patients with foodborne botulism: a systematic review and meta-analysis of cases, 1923-2016. Clin Infect Dis. 2017;66(suppl_1):43-56. https://doi.org/10.1093/cid/cix815
↑33. Никифоров ВВ, Томилин ЮН, Давыдов АВ, Зимин ПЕ, Алейникова ОИ. Случай тяжелого течения ботулизма: 127 дней искусственной вентиляции легких. Эпидемиология и инфекционные болезни. 2013;18(6):49-57. https://doi.org/10.17816/EID40793
↑34. Lonati D, Flore L, Vecchio S, Giampreti A, Petrolini VM, Anniballi F, et al. Clinical management of foodborne botulism poisoning in emergency setting: an Italian case series. Clin Toxicol. 2015;53:338.
Для цитирования:
Елисеева Е.М., Мазеркина И.А., Чистохина А.А. Нейротропное действие ботулинического токсина и возможности фармакотерапии ботулизма специфической сывороткой (обзор). Безопасность и риск фармакотерапии. 2024;12(3):299-308. https://doi.org/10.30895/2312-7821-2024-12-3-299-308
For citation:
Eliseeva E.M., Mazerkina I.A., Chistokhina A.A. Neurotropic Effect of Botulinum Toxin and the Potential of Specific Serum Therapy in Botulism (Review). Safety and Risk of Pharmacotherapy. 2024;12(3):299-308. (In Russ.) https://doi.org/10.30895/2312-7821-2024-12-3-299-308



































